Giulia Bezzini, Cecilia Giontella
La nimesulide: storia
e geografia di un famoso analgesico#
1. Premessa
Il 18 maggio 2007 appariva su La Repubblica [1], l’articolo qui di
seguito riportato integralmente:
|
Il principio attivo |
La ricetta |
La vendita |
L’ indagine |
|
La
nimesulide è il principio
attivo di una
serie di farmaci antinfiammatori
non steroidei.
Come molti farmaci
ha effetti collaterali
specie sul
fegato e sullo stomaco.
È commercializzato
in Italia
dal 1985, dopo
il via libera dell’Agenzia
Europea. |
I
farmaci griffati o generici
a base di nimesulide
possono essere
venduti dal farmacista
solo su presentazione
della ricetta
medica. Il consumo
degli antinfiammatori
in Italia
è molto diffuso e
spesso vengono assunti
senza tenere conto
degli effetti collaterali. |
L’Irlanda
non è
il primo Paese europeo
ad avere sospeso
la commercializzazione della
nimesulide. Nel
marzo del 2002 la
stessa decisione era stata
presa dalle autorità sanitarie
finlandesi e
nel maggio dello stesso
anno da quelle spagnole. |
Dopo
la sospensione di Spagna
e Finlandia, il
Comitato scientifico dell’Emea,
l’Agenzia europea
del farmaco, a
seguito dei controlli durati
due anni ha stabilito
che il rapporto rischio/beneficio
della nimesulide
era positivo. |
Le autorità sanitarie irlandesi ritirano i farmaci a
base di nimesulide dopo sei casi di insufficienza epatica grave
Aulin, Dublino vieta il principio attivo
l’Italia: dobbiamo rivalutare i rischi
ROMA – Il
principio attivo è la “nimesulide”. Il farmaco più conosciuto è l’Aulin ,
prodotto dalla multinazionale Roche. Da quando, tre giorni fa, le autorità
sanitarie irlandesi hanno deciso di sospendere la vendita del prodotto in
farmacia, in Europa è scattato l’allarme. L’Agenzia Italiana del Farmaco ha
subito chiesto una rivalutazione del profilo di sicurezza all’Emea, l’Agenzia
europea che vigila sui medicinali.
L’Emea ha deciso di prendere in esame il caso la
prossima settimana. La “nimesulide” è un antinfiammatorio non steroideo
commercializzato in Italia dal 1985. La decisione di ritirare il farmaco è
stata presa dalle autorità irlandesi dopo la segnalazione, da parte della
National Liver Transplant Unit dell’ospedale di St. Vincent di sei casi di
insufficienza epatica grave che hanno richiesto il trapianto di fegato.
L’azienda farmaceutica Roche rassicura sull’utilizzo
del farmaco, che ha un “altissimo profilo di sicurezza dimostrato dai circa 500
milioni di pazienti che ne hanno fatto uso negli ultimi 22 anni” e precisa
alcuni punti.
“Si sta ancora valutando – sostiene in una nota – la
presunta relazione tra l’utilizzo di nimesulide e i 6 casi di danni epatici
verificatesi tra il 1999 e il 2006 segnalati dall’Unità Nazionale Trapianti di
Fegato irlandese; il danno epatico è un raro evento avverso già noto per tutta
la classe terapeutica dei farmaci antinfiammatori non steroidei, come indicato
nel foglio illustrativo; uno studio pubblicato sul British Medical Journal il 5
luglio
Ma i farmaci possono far male? “Tutti hanno effetti
collaterali. Il fatto che non possano far male è fuori dal mondo – spiega Stefano Vella, direttore del
Dipartimento del Farmaco dell’Istituto Superiore di Sanità – il farmaco è
formato da elementi chimici che fanno sicuramente male perché hanno comunque un
impatto sulla salute del paziente. Questo non vuol dire che non servano.
Vengono autorizzati quando i benefici superano i rischi prodotti. Un esempio:
il cortisone salva la pelle a tante persone, ma ha effetti collaterali
devastanti. Il principio di cui si tiene conto è il rapporto rischi/benefici.
L’importante è che i medici siano molto attenti nelle prescrizioni – conclude
Vella – ma che soprattutto i pazienti capiscano che un farmaco non è una
caramella e l’eventuale abuso può essere molto pericoloso”.
Intorno ad una fotografia che ha
come oggetto un cassetto colmo di farmaci e sullo sfondo un farmacista in
camice bianco, sono riportati i seguenti trafiletti:
|
6 casi |
1985 |
25 milioni |
2006 |
|
Irlanda |
Italia |
Ricerca |
Consumi |
|
Sei
i casi di insuf-ficienza epatica grave che hanno richiesto il trapianto di
fegato nei pazienti che hanno usato farmaci a base di nimesulide. Da qui la
decisione. |
I
farmaci antinfiammatori a base di nimesulide sono stati commercializzati in
Italia nel 1985. I con-sumi sono cresciuti in maniera esponenziale fino al
2001 e al 2002. |
Da
uno studio condotto nel 2001 dall’Istituto Superiore di Sanità le confezioni
vendute furono 25 milioni. Dieci milioni i pazienti che hanno ingerito
nimesulide. Età media 66 anni. |
Nel
2006, ogni giorno, in Italia si sono consumati 7,2 dosi di nimesulide ogni
mille abitanti, pari allo 0,8% del totale dei 30 farmaci a carico del
Servizio sanitario na-zionale più consumati. |
La notizia è stata riportata su
tutti i quotidiani più importanti nello stesso giorno (La Stampa, il Corriere della
Sera…) ed è stata trasmessa anche ai telegiornali. Il contenuto della
notizia è molto simile, tranne piccole sfumature che tendono a calcare la mano
sulla gravità o meno della situazione. Su una rivista medica, GdM Giornale del medico (Anno XXIII, n.
12) la notizia appare in data 21 maggio 2007 col titolo “Ritirata la nimesulide
in Irlanda per sospetti gravi danni epatici” (da notare l’aggettivo
“sospetti”). La notizia è collocata a pagina 15 ( il giornale consta di 23
pagine) ed è un trafiletto piccolo in fondo alla pagina sulla sinistra: solo un
attento lettore avrebbe potuto notarla. Inoltre sottolineiamo il fatto che
sulla prima pagina di tutti i numeri di
questa rivista compaiono due pubblicità identiche, una alla sinistra e una alla
destra del titolo, riguardanti l’Aulin, uno degli antinfiammatori più usati e
conosciuti a base di nimesulide.
I contenuti delle notizie
riportate sono chiari e in tutte si parla di un importante episodio avvenuto
nel 2002.
Dalla lettura delle notizie sono
emersi molti interrogativi tra cui uno in particolare: come mai in tutti gli
articoli vengono citate Emea (Agenzia Europea per la Valutazione dei Farmaci),
Aifa (Agenzia Italiana del Farmaco), Federfarma (associazione che raggruppa i
titolari di farmacie), Nam (National Agency for Medicines, finlandese),
Codacons (Coordinamento delle Associazioni per
La sensazione percepita dal
lettore è che il “problema” sia confinato a livello europeo…
E inoltre: come mai i cittadini
considerano la nimesulide un farmaco “da banco”? Sono loro ad essere
“indisciplinati” o non hanno accesso ad informazioni corrette?
Per rispondere a questi interrogativi
è stato necessario ripercorrere tutta la storia della nimesulide. Ma andiamo
con ordine e cerchiamo di raccontare in cosa consiste e a cosa serve l’iter
procedurale per arrivare all’approvazione di un farmaco, come agisce la
nimesulide e qual è il suo impiego.
Generalità sull’immissione in commercio e sul ritiro dal mercato dei
farmaci
Anche se previsto nelle diverse normative nazionali,
il ritiro di un farmaco dal mercato per comparsa di ADR (adverse drug reaction –
reazioni avverse da farmaco) gravi e di un negativo bilancio rischi-benefici è
un processo laborioso e difficile.
Così scrivono Stefano Cagliano
(esperto di politica farmaceutica, lavora presso il Pronto Soccorso
dell’ospedale di Belcolle a Viterbo) e Mauro Miselli (farmacista, docente di
metodologia del monitoraggio sui farmaci all’Università di Modena e Reggio
Emilia) in un articolo apparso su Le
Scienze [2].
Il primo motivo è la difficoltà di raccolta dei dati
sulle ADR, sia per un deficit di segnalazione da parte dei medici, sia per una
sensibilità inadeguata degli organismi istituzionali. […] Un problema diffuso è
la disparità tra i fondi destinati alla sorveglianza post-marketing e quelli
destinati all’autorizzazione al commercio. Per esempio, il Ministero della
Sanità canadese incaricato della sicurezza sui farmaci dispone di un quinto
dello stanziamento annuale di quello dedicato alle domande di registrazione, ed
ha solo un quinto del personale. […] Un altro motivo di controversia sul ritiro
di un farmaco dal mercato è la mancanza di consenso tra gli addetti ai lavori
su quando si debba ricorrere ad una misura del genere. […]: se l’efficacia di
un farmaco è ben documentata, che peso deve essere dato all’evento che
suggerisce un provvedimento di revoca? Qui emergono notevoli differenze tra i
vari Paesi. A un estremo si collocano politiche ultraprotettive nei confronti
del farmaco (e della casa produttrice), dall’altro quelle ultraprotettive per
la salute della popolazione. Per esempio, i farmaci contenenti l’associazione
tra destropropoxifene e paracetamolo a scopo analgesico sono stati ritirati dal
commercio in Svezia e Gran Bretagna per la segnalazione di decessi causati dal
sovradosaggio, ma questo elemento non è stato ritenuto sufficiente in Francia.
[…] La qualità dei dati usati per decidere se ritirare
un farmaco varia molto. Da un riesame dei dati resi pubblici dalle autorità
statunitensi e britanniche su 11 farmaci negli anni tra il 1999 e 2001, è
emerso che quattro sono stati ritirati solo sulla base di segnalazioni
spontanee, e due in base alla dimostrazione di un effetto rilevante per il
malato ottenuta da studi comparativi. Per questo si auspicava la pianificazione
di studi prospettici che iniziassero nella prima fase di commercializzazione di
un nuovo farmaco. Un terzo aspetto è che le autorità regolatorie non hanno
tutte lo stesso potere in merito al ritiro dei farmaci dal mercato. Mentre in
Canada il ministero della Sanità può decidere unilateralmente, negli Stati
Uniti,
La fase 4, la sperimentazione più importante
Cagliano e Miselli [2] descrivono
poi l’attuale iter per l’introduzione in commercio di un nuovo farmaco:
Prima di essere messi in commercio, i farmaci vengono
sperimentati gradualmente per testarne l’efficacia e, in qualche misura, anche
la sicurezza, ovvero la maggiore o minore frequenza di effetti indesiderati. Il
processo parte naturalmente dai cosiddetti “test pre-clinici” effettuati su
cellule e su animali, che possono durare da
Soprattutto dopo quest’ultima
affermazione sorge spontaneo sospettare che i problemi relativi alle ADR nascano
proprio a causa dell’iter appena
descritto, a partire proprio dal primo passo, ossia dai test preclinici sugli
animali. All’epoca del disastro del Talidomide, negli anni ’50, il premio Nobel
Boris Chain aveva testimoniato che “nessun
test su animali può dare risultati sicuri”. In quella occasione
il verdetto del tribunale aveva accettato le
testimonianze dei grandi scienziati che confermavano l’impossibilità di potersi
accertare dell’innocuità di un farmaco provandolo su animali [3, pag. 217]
Ma il verdetto finale non fu,
come ci si aspetterebbe, che le prove su animali devono essere legalmente
vietate poiché, oltre che eticamente riprovevoli, sono inutili alla scienza.
La consapevolezza che un farmaco (il talidomide) potesse
provocare un danno simile -scrivono Cagliano e Miselli [2] – si tradusse nel 1962 nell’emendamento […] che
ha ispirato le normative nazionali sulla registrazione e il controllo dei
farmaci in gran parte del mondo. In quella norma si prese atto che per valutare
ogni nuovo farmaco occorrono graduali passaggi, [tra cui una serie di prove su
animali], il coinvolgimento di volontari sani e il consenso informato di chi
partecipa alle ricerche. […]. Si concluse, cioè, che bastassero prudenza, un
ingresso graduale sul mercato e, naturalmente, i presupposti farmacologici,
perché il farmaco mantenesse le sue promesse e riservasse poche sorprese. […].
Gli esami preclinici (cioè le prove
su colture cellulari e su animali), quindi, vengono mantenuti e saldamente
inseriti all’interno delle normative specifiche per l’approvazione dei farmaci
[4, art. 8 comma 3, lettera l e Allegato I, parte I modulo 4]. Anche oggi è
quindi opinione comune, anche se non avvalorata da nessuna prova scientifica, che
i test sugli animali siano indispensabili [5].
Inoltre, se anche i trial clinici
sono impostati in modo da valutare più i benefici prodotti dal farmaco che i
rischi da esso provenienti, ciò suggerisce che gli effetti indesiderati sono
rilevati incidentalmente ed in modo non sistematico.
Così quando il farmaco è assunto da decine di migliaia
di malati (cioè nella fase 4), con caratteristiche non proprio simili a quelli
coinvolti nei trial, possono esserci conseguenze inattese. Inoltre durante i
primi studi clinici non ci si preoccupa troppo delle interazioni con altri
farmaci. […]. Gli studi iniziali sono condotti (o su persone sane o) su malati
con una diagnosi precisa, in genere con l’esclusione di anziani, bambini, donne
in gravidanza, e questo condiziona ciò che si può scoprire sulla sicurezza del
farmaco.[…] Osserva il Drug &
Therapeutics Bulletin che «per avere una certezza del 95% di rilevare un
evento che si verifica con una frequenza di 1 caso su 1000 devono essere
esaminate 3000 persone», ma spesso i pazienti arruolati negli studi sono meno
di 1000. Maggiore è il numero di persone esposte al farmaco, maggiori sono le probabilità
di fare emergere effetti avversi gravi ma rari [2].
A scuola si dovrebbe insegnare che
una teoria è scientifica se:
1) non è ambigua o
contraddittoria;
2) ammette esperienze
falsificanti o ripetibili (cioè è vera fino a prova contraria);
3) si ricercano attivamente
esperienze falsificanti e si accetta un verdetto negativo.
Ora l’iter che attualmente
prevede la commercializzazione di un farmaco, considerato “scientifico”, sembrerebbe
eludere tutti e tre i punti appena enunciati.
Trovare gli animali su cui fare test
pre-clinici non sembra essere un problema per nessuno. Trovare le persone,
invece, comincia a diventarlo. Daniela Condorelli [6] scrive che
gli Occidentali sono sempre meno disposti a
partecipare ai test, anche quando potrebbero avvantaggiarsene […]. La
soluzione? La globalizzazione dei test. Perché un esperimento costa 10mila
dollari in Occidente, 3mila in Russia e la metà in Africa. Così le CRO, le
organizzazioni per la ricerca a contratto a cui si appoggia la ricerca, hanno
sede ovunque.
Il fatto è che poi i farmaci così
sperimentati, una volta registrati, verranno introdotti in un mercato non vergine in cui, a voler essere
ottimisti, si potranno almeno verificare problemi legati alle interazioni tra
farmaci. Cagliano e Miselli [2] continuano:
Le dimensioni del danno da farmaci sono preoccupanti
sia per la loro entità sia perché si tratta comunque di sottostime. In base ad
uno studio condotto negli Stati Uniti, il 6-7% dei pazienti ricoverati in
ospedale manifesta gravi reazioni avverse da farmaci e più di 100.000 americani
muoiono ogni anno per effetti indesiderati da farmaci. Un’indagine conclusa nel
2006 negli Stati Uniti su un campione di 63 ospedali ha indicato che circa
700.000 persone ogni anno si rivolgono al pronto soccorso per ADR, dovuti nel
40% dei casi ad analgesici o antibiotici […]. Ma questi numeri non rispecchiano
la realtà. In Gran Bretagna, un confronto diretto tra la segnalazione spontanea
di reazioni avverse e un sistema di monitoraggio delle ADR su oltre 44.000
persone ha indicato che la percentuale di mancate segnalazioni può arrivare al
98%. Uno studio condotto in Francia ha stimato che è stata segnalata solo una
reazione su 24.000 e che, anche in caso di reazioni gravi e non riportate in
etichetta, il numero di segnalazioni è stato di 1 su 4600. […] In Italia però
le segnalazioni di ADR sono più basse che altrove. Dal 2001 al 2005 hanno
oscillato tra le 6000 e le 7000 l’anno, con differenze importanti da Regione a
Regione e con un tasso ampiamente al di sotto dell’obiettivo ottimale di 30
segnalazioni per 100.000 abitanti raccomandata dall’OMS.
Ovvero: l’organo supremo per la tutela della
salute a livello mondiale si aspetta candidamente che in un Paese come l’Italia,
di circa 57 milioni di persone, in un anno ci siano circa 17.000 casi di
reazioni avverse. Questo dato, quindi, per l’OMS sarebbe “normale” e non
farebbe prevedere alcun provvedimento di indagine su come i farmaci vengono
prodotti.
In teoria il numero ridotto potrebbe essere spiegato
con differenze genetiche che rendono gli italiani più resistenti ai danni da
farmaci […]. È invece più probabile che i medici italiani
facciano semplicemente meno segnalazioni di ADR, magari solo perché
tendono a non attribuire ad un farmaco la responsabilità del problema che
assilla il malato. […]. A ciò si aggiunge il problema del tempo che intercorre
fra il momento in cui si ha la prima conoscenza concreta di un grave effetto
indesiderato e quello in cui intervengono le autorità regolatorie. L’iter che
va dalla decisione dell’autorità al provvedimento concreto alla comunicazione
ai medici e al pubblico è tutt’altro che efficiente . Ancora oggi succede che
nessuna informazione sia diffusa né venga presa alcuna decisione fino a quando
i dati disponibili non sono stati vagliati e discussi a lungo dall’autorità
sanitaria e dal produttore. A volte il provvedimento può essere attuato senza
un’informazione ufficiale, aggiornando semplicemente la scheda tecnica del
farmaco. Il risultato finale è che il ritardo causato da questa inefficienza
del sistema si somma a quello dovuto alle difficoltà insite nella raccolta di
informazioni sulle reazioni avverse sospette, e così un maggior numero di
malati corre un rischio evitabile.
Che cos’è la nimesulide
La nimesulide è un principio
attivo che fa parte del gruppo dei farmaci antinfiammatori non steroidei (Fans)
e commercializzata, a seconda della ditta produttrice, sotto il nome di Aulin, Mesulid, Nimesulene, Sulidamor ecc. Come tutti gli antinfiammatori, agisce
sulle prostaglandine, composti chimici
prodotti dalle membrane cellulari di quasi tutti gli organi del corpo. I
loro tessuti bersaglio sono solitamente gli stessi da cui vengono prodotte. Si
formano velocemente, esercitano i loro effetti localmente e vengono
successivamente degradate per via enzimatica o decadono spontaneamente.
Il meccanismo di formazione delle
prostaglandine è detto via cicloossigenasica, nome derivante dall’enzima
principale, la cicloossigenasi (Cox) che gioca una funzione regolatoria chiave
nella sintesi delle prostaglandine. Della Cox esistono due isoenzimi distinti
ma correlati:
-
-
I farmaci antinfiammatori non
steroidei (Fans) inibiscono l'enzima cicloossigenasi e sono ampiamente utilizzati per il
trattamento delle malattie infiammatorie. I Fans classici infatti sono attivi
indifferentemente sulle Cox-1 e sulle Cox-2, e si ipotizza che la tossicità
associata ai Fans sia causata dalla inibizione di Cox-1, mentre le proprietà
antinfiammatorie siano conseguenza della inibizione della Cox-2. Ciò ha suggerito
che gli inibitori selettivi di Cox-2 (quale il meloxicam – Mobic) siano in
grado di favorire un’attività antinfiammatoria con una tollerabilità renale
migliore rispetto ai Fans convenzionali non selettivi.
C’è da fare una precisazione:
recenti studi hanno mostrato come anche la nimesulide, Fans commercializzato quando
ancora non era stata riconosciuta l’esistenza dei due isoenzimi, sembra agire
in effetti come inibitore selettivo prevalente sulle Cox-2. Oggi, però, tra gli
inibitori più selettivi di Cox-2 si hanno il celecoxib (Celebrex) e
l’etoricoxib (Tauxib o Arcoxia) e il rofecoxib (il Vioxx) che hanno mostrato
comunque non favorevoli a carico del sistema cardiocircolatorio.
La selettività per
Indicazioni e posologia della nimesulide
Le indicazioni d’uso della
nimesulide per le formulazioni destinate ad un impiego sistemico devono essere
limitate a:
-
trattamento del dolore acuto;
-
trattamento sintomatico dell’osteoartrite dolorosa;
-
trattamento della dismenorrea primaria;
per le formulazioni ad uso
locale:
-
trattamento sintomatico del dolore associato a
distorsioni e tendiniti traumatiche acute.
La posologia massima giornaliera
non deve superare 100 mg per 2 volte al giorno.
La durata del trattamento deve
essere il più breve possibile, in relazione alle condizioni cliniche del
paziente.
Le fasce di pazienti in cui il
farmaco non deve assolutamente essere usato:
-
i bambini (al di sotto di 12 anni);
-
le donne durante il terzo trimestre di gravidanza e in
allattamento;
-
i pazienti con ridotta funzionalità epatica, con
sintomi di danno epatico o che assumono altri farmaci epatossici;
-
i soggetti che fanno abuso di alcolici.
Questo è quanto stabilito dal
CHMP, comitato scientifico dell’Emea, nel
Storia della nimesulide
Leggiamo su un sito di
informazione medica (www.Xagenasalute.it):
La nimesulide è stata sintetizzata dalla 3M negli
Stati Uniti e venduta ad una società farmaceutica svizzera, Helsinn Healthcare
SA, che a sua volta la diede in licenza, per l’Italia, alla Boehringer
Mannheim, che lanciò la nimesulide con il nome di Aulin nel 1985.
Ma analizziamo meglio questo fatto: la storia della
nimesulide si intreccia con quella di un altro antinfiammatorio, il
benoxaprofene. Nel 1982 il benoxaprofene (Opren) venne ritirato a causa della
grave tossicità epatica. Il ritiro dal commercio avvenne dopo la morte di 61
pazienti, prevalentemente anziani, che stavano assumendo il benoxaprofene. Il
Committee on Safety of Medicines (CSM) inglese ricevette 3.500 segnalazioni di
reazioni avverse associate all’uso di tale antinfiammatorio. La prima
segnalazione di mortalità si ebbe ad aprile-maggio del 1982; otto donne anziane
che avevano assunto il farmaco svilupparono ittero colestatico, sei delle quali
morirono.
Il caso del benoxaprofene portò ad un irrigidimento
delle Autorità Sanitarie, con conseguente difficoltà per i farmaci
antinfiammatori ad ottenere l’autorizzazione alla commercializzazione […] Con
molta probabilità anche 3M decise di non investire tempo e risorse per lo
sviluppo clinico della nimesulide e ne cedette i diritti di commercializzazione
alla piccola società farmaceutica svizzera con sede a Lugano,
Nel 1998 Boehringer Mannheim fu
acquistata dalla società farmaceutica svizzera Roche, una delle più grandi
industrie farmaceutiche nel mondo.
Quindi la nimesulide, nata negli
Stati Uniti, non è commercializzata nel paese di origine...
Andando più in dettaglio nella
storia dello sviluppo di questo farmaco, sembra che esso sia una sorta di
fallimento riciclato: il progetto originario mirava a produrre un
chemioterapico molto infiltrante capace di uccidere selettivamente le cellule
in rapida proliferazione, discriminando tra cellule “buone” e “cattive” sulla
base del fatto che quelle “cattive” solitamente hanno un metabolismo molto più
accelerato, che tende a diventare molto presto carente di ossigeno e glucosio.
Il problema che venne fuori fu che la molecola era sì molto infiltrante e
discriminava bene tra cellule “buone” e “cattive”, ma alla dose in cui aveva
efficacia antitumorale, uccideva anche le
cellule normali e soprattutto bloccava anche l’azione infiammatoria dei globuli
bianchi.
Quindi in pratica non era un’arma
abbastanza intelligente o efficace per funzionare bene come antitumorale, ma
comunque riusciva ad arrivare dovunque e bloccare le infiammazioni. Per un po’
tentarono di variare la struttura chimica per migliorarla, poi chi se ne
occupava lasciò perdere e la nimesulide venne recuperata qualche anno dopo come
antinfiammatorio di tipo particolare.
Geografia della nimesulide
Sono tanti altri i paesi nei
quali tale antinfiammatorio non è disponibile (in oltre 150!): Gran Bretagna,
Canada, Germania, Giappone, Finlandia, Spagna, Australia, Turchia...
Emblematico fu il caso della
Finlandia che nel 2002 decise la sospensione del farmaco a causa di un aumento
di segnalazioni di tossicità epatica (danni al fegato): nel periodo 1998-2002
giunsero alla National Agency for Medicines (NAM) finlandese, 109 segnalazioni
di sospette reazioni avverse, per il 60% a carico del fegato; due pazienti
furono sottoposti a trapianto di fegato ed uno addirittura morì. Le analisi
condotte sulle segnalazioni di reazioni avverse evidenziarono che l’insorgenza
di una reazione epatica si era verificata dopo una media di 50,8 giorni
dall’inizio del trattamento (il 27% dei casi era insorto entro 7 giorni, il 35%
tra 8 e 29 giorni, il 38% dopo 30 giorni).
Anche
Un’altra testimonianza
dell’epatossicità della nimesulide fu messa in rilievo da una lettera inviata
al British Medical Journal nel 2003 da
Kunal Saha dell’Ohio State University Medical Center a Columbus negli Stati
Uniti, riguardante la situazione indiana (se ne riporta la traduzione):
In India l’uso della nimesulide nei bambini crea
sconcerto. Numerosi studi hanno mostrato che la nimesulide è associata ad
effetti epatossici. La nimesulide non è usata negli Stati Uniti, e molti Paesi
europei l’hanno bandita a causa di un’incidenza non accettabile di gravi
reazioni avverse.
Sebbene alcuni studi abbiano indicato che la
nimesulide possa essere utilizzata nei pazienti con osteoartrosi e problemi
gastrici, altri farmaci come Acetaminofene (paracetamolo) rappresentano una
migliore scelta come antipiretici o analgesici, specialmente per i bambini. Non
c’è nulla di razionale nell’utilizzare la nimesulide come primo farmaco da
scegliere per febbre e dolore. Studi pubblicati indicano che in India c’è un
uso sfrenato di nimesulide. Infine sono disponibili 12 farmaci ad uso
pediatrico a base di nimesulide, ciò sta ad indicarne un ampio uso tra i
bambini.
A mala pena ogni seria sorveglianza post-marketing per
reazioni avverse dovute all’uso del farmaco è assunta in India. Inoltre, a
differenza dei paesi occidentali, i medici indiani non sono soggetti ad un
reale controllo e perciò non necessariamente seguono con rapidità le nuove
informazioni sugli effetti collaterali. I pazienti che ricevono la nimesulide
dovrebbero essere direttamente monitorati per lo sviluppo di insufficienza
epatica. Tuttavia, per ragioni economiche, è difficile per i pazienti indiani
sottoporsi a questi controlli […]” [16].
Tutto questo ci fa capire la
grande libertà che regnava sull’utilizzo di questo antinfiammatorio. Questi
fatti portarono l’Emea [10], allertata soprattutto dalle autorità sanitarie
finlandesi, a sottoporre la nimesulide ad un riesame, giungendo alla
conclusione che il rapporto rischio-beneficio del farmaco fosse positivo. Ciò
confermò il mantenimento della registrazione di questo prodotto in tutti gli
stati dell’Unione Europea, inclusa
La situazione italiana
L’Italia è uno di quei Paesi in
cui si consuma molto nimesulide. Nel 2002 si è registrato il più alto consumo
rispetto al resto d’Europa, e solo nel corso del 2006, secondo uno studio
dell’associazione Codici, ogni giorno si sono consumate 7,2 dosi di nimesulide
– 100 mg – ogni mille abitanti.
In effetti per l’Italia si può
parlare di frequente abuso di questo farmaco: si pensi a
quante volte si sentono delle persone che per un mal di testa o di denti sono
ricorse all’Aulin. Questo denota una grave superficialità, perché non tutti
sanno che – come abbiamo ricordato sopra – la nimesulide è tossica per le
cellule nervose che sono in deficit di ossigeno e glucosio, ovvero per le
cellule in forte attività; e soprattutto non viene detto che la nimesulide
bersaglia tutte le cellule. Quando si
prende un farmaco contenente nimesulide per il mal di gola o di denti, in
realtà non si è preso altro che un blando
antitumorale che è particolarmente dannoso per quegli organi e tessuti (rene,
fegato e stomaco) costituiti da cellule in rapida proliferazione.
Ciò nonostante, in Italia non si
è assistito ad un’elevata casistica di effetti collaterali. Probabilmente lo si
deve, oltre che ai difetti della farmacovigilanza descritti da Cagliano e
Miselli, alla modalità d’impiego del farmaco, utilizzato più a scopo
antidolorifico che antinfiammatorio quindi per brevi periodi di tempo (cefalee,
dismenorrea, mal di denti, dolori da contusione ecc.), anche se il Sistema
Sanitario Nazionale ne prevede la rimborsabilità (attraverso la nota 66) per il
trattamento di problematiche infiammatorie croniche di tipo osteoarticolare. Ne
nasce l’incongruenza che nel Sistema Sanitario Italiano la molecola è
ufficialmente consacrata a quell’uso che risulta essere quello più a rischio
nel provocare danni anche seri per la salute.
Quindi, in conclusione, farmaci
tipo Aulin, nati come antitumorali, poi “riciclati” ad antinfiammatori, in
Italia vengono usati prevalentemente a scopo antidolorifico o per curare
sintomi similinfluenzali. Tale modalità rappresenta un abuso e un errore perché
esistono altri antidolorifici (per es. il paracetamolo – Tachipirina,
Efferalgan) che nascono come tali, e che, non agendo con lo stesso meccanismo
antiprostaglandinico, sono in grado di essere meglio tollerati dal nostro
organismo. Se però Aulin e simili vengono prescritti secondo l’uso che ne
prevede il Sistema Sanitario Nazionale, quindi con una somministrazione di più lunga
durata, ciò comporta una maggiore probabilità di andare incontro a gravi
effetti collaterali (soprattutto a danno del fegato). Infatti, in molti paesi
in cui la nimesulide è destinata a questo uso (in Finlandia molte segnalazioni
di effetti collaterali riportano un uso prolungato – fino a 500 giorni di
terapia – per patologie reumatiche quali l’osteoartrite), la molecola è stata
ritirata dal commercio.
Ma allora da tutto questo capiamo
che forse c’è qualcosa che non va… Oggi in Italia una scatola di Aulin costa
circa 1 euro, ma dato l’enorme e spropositato consumo che se ne fa, sia perché
funziona bene come antidolorifico (è infatti più forte rispetto a Tachipirina e
simili per i motivi che abbiamo detto), sia perché facilmente acquistabile senza ricetta medica (ritorneremo su questo
punto importante) e ad un prezzo molto basso, rappresenta un grosso guadagno
per le industrie farmaceutiche che fino ad oggi non si sono preoccupate di
controllare e correggere l’uso sbagliato che se ne fa.
Ma allora ci chiediamo: se in
seguito allo scandalo finlandese del 2002 l’Emea, dopo due anni di valutazioni,
ha detto che la nimesulide poteva continuare ad essere commercializzata considerando
il suo profilo di sicurezza, come mai a distanza di cinque anni si è
ripresentata in Irlanda una situazione analoga?
Il caso nimesulide: sviluppi recenti
L’Aifa ha monitorato in questi anni il profilo di
sicurezza della nimesulide; metterà a disposizione i dati nazionali e
parteciperà alla rivalutazione del farmaco a livello europeo. Nel frattempo
l’agenzia ha richiamato i medici, farmacisti e cittadini alla scrupolosa
osservanza delle informazioni relative al farmaco (da dispensare solo su
ricetta) con riguardo al rispetto di indicazioni, controindicazioni, posologia.
Così risponde un giornalista di Salute di Repubblica, nella rubrica “Lettere alla redazione”, in merito alla domanda di un lettore sulle
vicende della nimesulide [8].
Come già accennato in precedenza,
il problema “nimesulide” era già saltato fuori qualche anno fa e, più
precisamente, in Finlandia nel 2002. Relativamente a quella occasione, si
leggeva su
Le autorità sanitarie finlandesi hanno deciso di
sospendere in via cautelativa tutti i farmaci che contengono il principio
attivo Nimesulide […] dopo la segnalazione di un caso sospetto di morte per
insufficienza epatica. [9].
In quest’ultimo articolo si legge
che il principio attivo è contenuto in Italia in quindici antinfiammatori e antidolorifici Il commento
dell’allora ministro della salute Sirchia nello stesso articolo è stato
benevolo e tranquillizzante:
“Stiamo valutando, anche se non abbiamo alcuna
evidenza in questo senso si procederà esaminando le schede delle valutazioni
per verificare se in Italia sono stati rilevati casi analoghi, ma a noi, fino
ad oggi, non sono arrivate segnalazioni di effetti collaterali gravi. Occorre
poi che i nostri dati vengano confrontati con quelli degli altri paesi europei
prima di prendere decisioni”.
In realtà i problemi legati ai
FANS sono già noti da tempo: a pag. 239 de La
Figlia dell’Imperatrice [3] si legge il comunicato dell’agenzia CP di
Montreal del 4 agosto
Comunque, tornando al punto, se
da un lato è possibile che in Italia ci siano meno effetti collaterali, non si
può escludere che i medici italiani
facciano semplicemente meno segnalazioni di ADR… E poi, secondo il
Ministro, serve tempo: bisogna verificare se i dati sono affidabili, in barba
al principio di precauzione…
Insomma, se queste sono state le
affermazioni dell’Autorità, che cosa avrebbe dovuto dire
“Eravamo
già stati informati venerdì scorso e abbiamo inviato subito i nostri dati sulla
sicurezza e gli effetti collaterali del farmaco al Ministero della Salute -
afferma Claudio Rossi, responsabile del marketing Aulin - ma negli ultimi dieci
anni non abbiamo registrato che pochi casi di disturbi lievi. Siamo tranquilli,
in Italia si vendono due milioni e mezzo di farmaci con il principio attivo
Nimesulide al mese e non ci sono mai stati problemi” [9]
N. B. Ammettendo un ipotetico
costo di circa 1€ a confezione per questi farmaci venduti, il guadagno delle
case produttrici è di 2.500.000 di euro al mese solo con il nimesulide...
Nonostante le raccomandazioni
“benevole” del 2002, oggi la nimesulide è tornata a far parlare di sé. Sul sito
“paginemediche.it”si legge [11]:
[...] l’AIFA ha diramato una nota nella
quale si chiarisce che il profilo di sicurezza della nimesulide è sempre sotto
costante monitoraggio e che l’agenzia «parteciperà attivamente alla
rivalutazione del farmaco a livello europeo». L’AIFA ricorda anche che la
nimesulide può essere venduta solo dietro prescrizione medica e questo
monito coglie impreparati quei cittadini che hanno sempre acquistato la
nimesulide senza dover mai presentare alcuna ricetta.
Di fronte alle inevitabili polemiche, accese dopo che
migliaia di cittadini italiani hanno scoperto di aver avuto accesso al farmaco
senza aver mai dovuto presentare alcuna ricetta, Federfarma
replica con una nota nella quale dichiara che “i
farmaci a base di nimesulide non sono mai venduti nelle farmacie italiane come
medicinali Otc (over the counter), cioè senza ricetta” e che “nessun
farmacista ne consiglia l’uso se non è strettamente necessario, proprio per via
delle possibili controindicazioni al fegato dovute al sovradosaggio, già note a
tutti da tempo”; nonostante
ciò, Federfarma si è impegnata a inviare a tutti i farmacisti “una circolare che mette in guardia da un uso poco
accorto e dal vendere il farmaco senza ricetta medica”.
Alla decisione irlandese fa eco il commento dei medici
internisti, riuniti nei giorni scorsi in convegno, che ricordano come per anni
la nimesulide abbia “goduto della fama di
farmaco non molto rischioso, ma come ogni anno si registri un numero abbastanza
preoccupante di pazienti che subiscono danni epatici e dell’apparato
gastroenterico causati proprio da questa molecola”.
Ora, ammesso che il rapporto
rischi-benefici della nimesulide sia positivo, da quello che leggiamo il
problema principale non sembra riguardare il principio attivo che provoca
reazioni avverse ma i cittadini ed il fatto che non sanno prendere la medicina…
Ma se questo è veramente il problema, perché non avviare da parte del Ministero
della Salute o chi per lui una bella campagna di informazione capillare, che
informi seriamente i cittadini e che non si limiti solo a sostituire una frase
nel foglietto illustrativo?
Sul
sito di Altroconsumo si legge in merito alla nimesulide:
[la nimesulide] rappresenta una vera e propria
particolarità farmaceutica: il nostro paese infatti assorbe da solo il 60 per
cento del consumo mondiale di questo principio attivo, che invece è già stato
ritirato dal mercato in Finlandia e Spagna. […] ricordiamo che la nimesulide
richiede ricetta medica proprio perché i suoi effetti collaterali (e in
particolare quelli al fegato) sono più pesanti di quelli degli altri antinfiammatori.
[12]
Anche su un articolo pubblicato
il 18 maggio 2007 sul sito del Corriere
della Sera [13] è messo in evidenza l’allarme da parte dei medici
internisti italiani i quali sottolineano il fatto che “per molto tempo la nimesulide ha goduto della fama di un farmaco non
molto rischioso”. Allo stesso tempo mettono in evidenza che le ADR per la
nimesulide esistono e come, al contrario di quanto affermato da Sirchia [9]:
[...] ogni anno, noi medici internisti, osserviamo un
numero abbastanza preoccupante di pazienti che subiscono danni epatici e
dell'apparato gastroenterico causati proprio da questa molecola. […]. La
nimesulide viene considerata una molecola di facile uso - spiega il presidente
- quasi fosse un farmaco da banco, ma è tutt'altro che un medicinale innocuo.
A questo punto può venire in
mente che i cittadini non sappiano prendere la medicina perché per anni chi l’ha
prescritta loro non era informato abbastanza bene sui danni che essa poteva
produrre sull’organismo, trattando questo principio attivo con troppa
superficialità.
Ma chi informa i medici sui
rischi e i benefici di un certo principio attivo?
Si è già sottolineato come nello
studio di un nuovo farmaco venga data più importanza alla ricerca del
“beneficio” piuttosto che alla ricerca del “rischio” connesso al suo utilizzo
per cui, già in partenza, è difficile avere un quadro chiaro sull’effettiva efficacia
di quel farmaco.
A tale circostanza si sommano
altre due situazioni molto sfavorevoli per la salute del cittadino.
La prima (anche questa già analizzata)
si riferisce al fatto che, specialmente in Italia, le comunicazioni di ADR agli
enti preposti alla farmacovigilanza sono pochissime e quindi non ci sono abbastanza
dati a disposizione adatti a percepire che quel principio attivo faccia male.
La seconda è legata al fatto che, come ribadito nell’art.
113 del D. Lgs. 219/2006 [4], la pubblicità ai medicinali possa essere fatta
direttamente dalle case farmaceutiche ai signori medici. Il comma 1 del citato
articolo dice esattamente
“[…] per pubblicità dei medicinali si intende qualsiasi
azione d’informazione, di ricerca della clientela o di esortazione, intesa a
promuovere la prescrizione, la fornitura, la vendita o il consumo di
medicinali; essa comprende in particolare la pubblicità dei medicinali presso
persone autorizzate a prescriverli o a dispensarli, compresi gli aspetti
seguenti:
1) la visita di
informatori scientifici presso persone autorizzate a prescrivere o a fornire
medicinali;
2) la fornitura di
campioni di medicinali;
3) l’incitamento a
prescrivere o a fornire medicinali mediante la concessione, l’offerta o la
promessa di vantaggi pecuniari o in natura, ad eccezione di oggetti di valore
intrinseco trascurabile;
4) il patrocinio di
riunioni promozionali cui assistono persone autorizzate a prescrivere o a
fornire medicinali;
5) il patrocinio dei
congressi scientifici cui partecipano persone autorizzate a prescrivere o a
fornire medicinali, in particolare il pagamento delle spese di viaggio e di
soggiorno di queste ultime in tale occasione”,
cioè una specie di “lavaggio del cervello” da parte delle
case produttrici verso chi dovrebbe consigliare il meglio per la salute del
cittadino.
L’Aulin viene venduto davvero solo su prescrizione medica?
A tutto svantaggio dei cittadini
è anche il comportamento dei farmacisti: gli unici prodotti a base di
nimesulide vendibili senza prescrizione medica sono i gel antinfiammatori; per
gli altri, in forma di compresse o bustine granulate, la ricetta è
obbligatoria! Queste sono le norme e Federfarma sottolinea come il medicinale “non viene mai venduto senza ricetta e nessun
farmacista ne consiglia l’uso se non è strettamente necessario, proprio per via
delle possibili controindicazioni al fegato dovute al sovradosaggio” [11].
Ma la realtà è un’altra!
Trascriviamo una pagina dal sito
del Giornale (www.ilgiornale.it)
che fa vedere come stanno le cose:
Sette farmacie sparse nella zona di Porta Genova,
Corvetto e stazione Centrale. Il gioco è semplice: si entra, si chiede
dell’Aulin o comunque un antidolorifico a base di nimesulide e si aspetta la
reazione del farmacista. Risultato? Ben tre commessi prelevano la confezione
richiesta dagli scaffali e la pongono nelle mani del cronista, camuffato da
cliente, senza battere ciglio. Solo una giovane dipendente abbozza una domanda:
- Lo ha già preso altre volte?- Sì. E spariscono le titubanze.
Altri due titolari oppongono qualche resistenza,
almeno all’inizio. – Ma lo vuole davvero? Non ha sentito che casino è uscito in
Irlanda? Sono morte anche delle persone…– . – Le suggerisco il Momendol, che è
migliore e meno pericoloso dell’Aulin – . Basta insistere un poco, però, per
ottenere la confezione desiderata. Anche se uno dei due farmacisti precisa: –
Detesto l’Aulin e lo sconsiglio, ma se proprio mi rompe le palle glielo vado a
prendere –. Alla ricetta non si fa alcun cenno.
In un’altra farmacia non è possibile acquistare alcun
medicinale a base di nimesulide senza ricetta. Peccato, però, che come
sostitutivo per curare un acuto mal di denti si indichi l’Oki. Un altro
antinfiammatorio per cui sarebbe necessaria la prescrizione del medico. Solo in
un esercizio, la farmacia Nazionale di corso Colombo, il prontuario
farmaceutico è rispettato al cento per cento. Come antidolorifico viene fornito
un prodotto a vendita libera, il Voltadol. – Ha letto che polemica sulla
nimesulide? Senza ricetta proprio no –, sentenzia una commessa. Una farmacia su
sette, insomma, supera a pieni voti il test.
Tutto questo è accaduto, come si
capisce dal testo, dopo la diffusione della notizia del ritiro dal commercio
della nimesulide da parte delle autorità irlandesi. E se questo tipo di
indagine fosse stata condotta prima di tale episodio?
Comunque, a seguito della
sospensione della nimesulide in Irlanda, l’Aifa si è mossa ed ha pubblicato nel
suo bollettino di maggio-giugno 2007 [14] un resoconto sulle ADR prodotte dalla
nimesulide in Italia nel periodo 2001-2007 e, da quanto si legge, non c’è da
stare molto allegri soprattutto se si ricorda che gli Italiani sono un po’
pigri [2] ad inviare segnalazioni ADR:
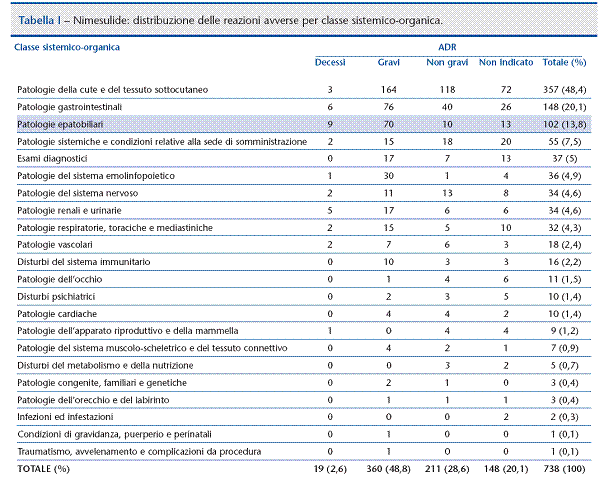
Nella Rete Nazionale
di Farmacovigilanza sono inserite 738 segnalazioni di sospette reazioni avverse
(ADR) alla nimesulide insorte tra il 1 gennaio 2001 al 17 maggio 2007; di
queste segnalazioni 360 (48,8%) sono costituite da casi gravi, 19 (2,6%)
sono state fatali. Le segnalazioni di ADR alla nimesulide, sia le totali sia
quelle epatiche, hanno avuto un picco intorno al 2002, probabilmente per
effetto del primo referral, ed
in seguito sono andate progressivamente diminuendo. […]. I dati (in tabella I) mostrano
come i disordini epatobiliari risultino la terza causa più frequente di ADR associata
all’uso di tale farmaco. 102 segnalazioni riguardano reazioni epatobiliari: di
queste 9 casi sono stati fatali, 70 gravi, 10 non gravi ed in 13 la gravità non
è stata riportata.
L’uso della nimesulide
nella maggioranza dei casi è stato di breve durata (da
In conclusione i dati
italiani:
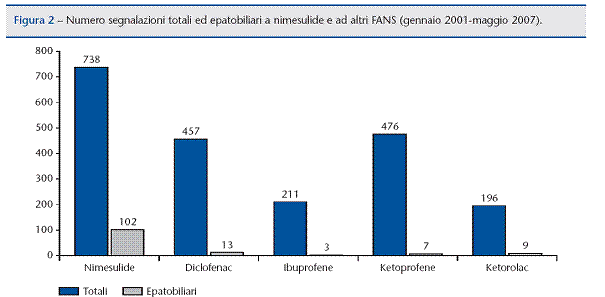
1) confermano la maggiore epatotossicità rispetto agli
altri antinfiammatori;
2) confermano che le
reazioni epatiche sono comunque molto rare;
3) suggeriscono l’ipotesi
di una reazione di idiosincrasia a causa della breve durata del trattamento;
4) sembrano indicare, per la presenza di altri farmaci
sospetti e/o concomitanti potenzialmente in grado di dare reazioni epatiche,
una “percezione” di innocuità della nimesulide;
5) confermano infine la necessità di identificare
ulteriori soluzioni regolatorie diverse e più efficaci di quelle adottate nel
corso del precedente referral,
dato che la nimesulide continua ad essere prescritta a pazienti con
controindicazioni (pregresse epatiti, storia di abuso di alcool, uso
concomitante di farmaci epatotossici). […]
Ovvero: La nimesulide, oltre ad essere un farmaco inutile
(ce ne sono altri che hanno gli stessi effetti), è anche il più dannoso di
tutti. Quello che viene spontaneo chiedersi è a che pro tenerlo ancora in
commercio?
Inoltre, come mai la nimesulide continua
ad essere prescritta “male” cioè, come specificato nel punto
Della vicenda nimesulide sui
giornali si è parlato per un tempo molto limitato e senza scendere nei dettagli
del problema. Come è possibile che i cittadini vengano a conoscenza di un
problema che li riguarda così da vicino con un’informazione del genere?
Il caso nimesulide è solo la punta dell’iceberg: i farmaci
ritirati dal mercato sono un’infinità non solo nel passato ma anche nel
presente. Esempio: il 31 agosto 2007 l’AIFA ha ritirato dal mercato il silomat –
clobutinolo - un sedativo per la tosse (da banco in forma di sciroppo, con
ricetta ripetibile sotto forma di gocce) commercializzato dal 1961 dalla Boehringer Ingelheim Italia; l’ADR più
comune è l’aritmia ma in Italia non erano mai giunte finora segnalazioni in
proposito! Eppure, ripetendo recentemente studi non-clinici (ancora animali!) ed
uno studio clinico su volontari sani, si sono accorti che lo studio clinico (e
quello pre-clinico? non viene più nominato nel seguito) indica possibilità di
aritmia nei soggetti sani trattati con clobutinolo. Il tutto è stato reso noto
nell’agosto 2007 [15][1]).
L’Aifa nel rapporto promette [14]:
tutti i dati
disponibili, inclusi eventuali dati aggiuntivi provenienti dai Centri trapianti
degli Stati Membri, verranno rivisti dal CHMP che esprimerà la propria opinione
sul mantenimento in commercio, o su una sospensione o revoca della nimesulide,
nella riunione di luglio.
L’EMEA
ha reso noto il suo parere il 21 settembre 2007 pronunciandosi
inequivocabilmente: i benefici continuerebbero
ad essere superiori ai rischi, per cui il farmaco deve rimanere saldamente in
commercio. [17]
Ma
allora, che cosa si fa allora per “placare gli animi”? Vengono aggiunte delle
precauzioni:
Il CHMP ha raccomandato che il
trattamento con nimesulide venga limitato ad un massimo di 15 giorni e che, di
conseguenza, tutte le confezioni contenenti più di 30 dosi (compresse o
bustine) siano tolte dal mercato. Si consiglia ai medici di basare la propria
decisione di prescrivere nimesulide su una valutazione dei rischi complessivi
del singolo paziente.
Tuttavia, nelle Faq messe a
disposizione dall’Aifa sul suo sito si legge [18]:
Il CHMP riconosce che non è noto il meccanismo che
determina gli effetti epatici della nimesulide e che ciò rende difficile
prevedere se il singolo paziente che assume il farmaco può essere a rischio di
sviluppare reazioni epatiche. Il Comitato ha specificato che la nimesulide non
deve essere utilizzata contemporaneamente ad altri farmaci che possono
ugualmente causare danno epatico o in pazienti con danni epatici preesistenti.
Inoltre, raccomanda di adottare ulteriori misure di sorveglianza, di condurre
studi per valutare il rischio di danno epatico nei pazienti che assumono
nimesulide e di diffondere una nota informativa agli operatori sanitari per
sottolineare le corrette modalità di utilizzo della nimesulide.
Ma com’è possibile stare
tranquilli se l’Emea stessa ha bisogno di ulteriori studi per poter capire come
funzionano le reazioni epatiche avverse? Dato che il farmaco è rimasto in
commercio, seppur con qualche restrizione (spero non solo) burocratica, ci
sembra di capire che gli “studi” caldamente auspicati dall’Aifa continueranno
ad essere perpetuati sulla pelle dei
malati, senza neanche informarli adeguatamente…
Ultimi aggiornamenti
Dalle Note Aifa del 25 gennaio 2008 arrivano i seguenti aggiornamenti
Nimesulide,
precisazioni sul numero di confezioni dispensabili per ricetta
Informazioni in merito ai recenti
provvedimenti dell’AIFA concernenti le modalità di prescrizione e dispensazione
dei medicinali a base di nimesulide.
In riferimento ai
recenti provvedimenti concernenti le modalità di prescrizionee dispensazione
dei medicinali a base di nimesulide, è stato posto all’AIFA il quesito se il
farmacista è tenuto a respingere (o ad evadere parzialmente) una prescrizione
di 2 scatole di nimesulide contenenti 30 unità posologiche e se
Al riguardo si precisa che è stata in più
occasioni evidenziata la necessità di non superare i quindici giorni di
trattamento con nimesulide in relazione al rischio di epatotossicità.
Anche in assenza di provvedimenti specifici
che vietano una prescrizione di 2 confezioni da 30 unità posologiche, le
evidenze disponibili e tutte le raccomandazioni emanate dalle autorità
regolatorie devono portare a comportamenti prudenziali limitando la terapia a
15 giorni.
Ciò premesso il farmacista può evadere
parzialmente la prescrizione fornendo al paziente una sola confezione e
trattenendo la ricetta.
Ne consegue che sarà rimborsata una sola
confezione da parte della ASL in caso di prescrizione SSN con nota 66.
Il 25 marzo 2008 appare un’altra
notizia, quasi invisibile sulla stampa nazionale:
La 24enne morta a Bari
era affetta da malformazione cardiaca
BARI –
Una forte malformazione cardiaca della quale non era a conoscenza: è quanto
emerge dal primo esame autoptico sulla 24enne morta nella notte tra sabato e
domenica dopo aver preso un espressino al bar, a Bari, e dopo aver bevuto,
sciolto nell’acqua, il contenuto di una bustina di antinfiammatorio, per curare
un attacco di emicrania. Sulla sua morte è stata aperta un’inchiesta contro
ignoti. La donna, Michelina Pascazio, madre di un bimbo di tre anni, del
quartiere ex Enziteto di Bari, quella notte è uscita di casa per fare un giro
in centro con la sorella e alcuni amici. In un pub avrebbe bevuto sostanze
alcoliche, forse una birra. Poi intorno alle
L’agenzia ANSA precisa il parere
del prof. Caprino nel modo seguente (stessa data)
Farmaci:
farmacologo, Nimesulide non pericolosa
(ANSA) - ROMA, 25 MAR - È
estremamente difficile che il Nimesulide abbia avuto qualche responsabilità
nella morte della ragazza a Bari. Lo afferma Luciano Caprino, farmacologo
dell'università La Sapienza di Roma. “Non è mai stato descritto nessun episodio
del genere seguito all'assunzione - spiega l'esperto - l'unica controindicazione
che è emersa da questo farmaco, che si usa da più di trent'anni, è che in
Finlandia ha provocato delle epatiti, ma non c'entra con questo episodio” .
Caprino apparentemente ignora che per la nimesulide
sono stati descritti effetti avversi gravi, e anche decessi, riguardanti sistemi
diversi da quello epatobiliare. Comunque è la logica che merita di essere
sottolineata: una segnalazione di una reazione avversa non vale se non
rassomiglia a una segnalazione già acquisita...
I
cittadini possono dormire sonni tranquilli, quindi?...
Gli
articoli del 23 maggio 2008 e del 22 giugno 2008 riportati qui di seguito sembrano
rispondere a questa domanda in modo inequivocabile...
Mazzette per evitare i controlli sull'Aulin
Farmaci e tangenti, filmata la
consegna di soldi al vice capo dell'Aifa
(di Mario Pappagallo, apparso sul Corriere della Sera il 23 maggio 2008 [20]):
MILANO — Tra i 30 indagati del nuovo
scandalo farmaci c'è anche un neosindaco. Carlo Della Pepa, 46 anni, medico e
ricercatore della farmacologia di Torino, eletto a Ivrea per una coalizione di
centrosinistra. Il suo capo è il farmacologo di Torino Mario Eandi. Poi manager
di primo piano della Bayer, Umberto Filippi e Roberto Ceresa (ex Lega Nord).
Incontri con il «numero uno» dell'Aifa (l'Agenzia italiana per
l'approvazione e la sorveglianza sui farmaci) Nello Martini sono agli atti
dell'inchiesta torinese guidata da Raffaele Guariniello. E che oltre alla
corruzione ipotizza un sistema che potrebbe avare arrecato danni alla salute
dei cittadini. Un esempio: il caso Aulin. Nimesulide è la molecola, Aulin è il
farmaco più noto tra i molti in commercio che contengono questo principio
attivo. Un anti-infiammatorio (Fans) che può anche avere gravi effetti
collaterali sul fegato. Mai approvato negli Stati Uniti e in Giappone. Ritirato
nel
L'Italia nicchia, a chi ne chiede il
ritiro viene risposto che i benefici in un certo sono superiori ai rischi. Basta rispettare l'obbligo di
prescrizione da parte del medico. Di verifiche e studi per appurarne la reale
pericolosità non se ne parla. Solo monitoraggio. Perché? La risposta in un filmato
di due minuti. Un mediatore passa una mazzetta a Pasqualino Rossi per «lasciare
tranquillo» l'Aulin. Un regista con le stellette ha immortalato immagini e
suoni del pagamento in contanti, la gioia del numero due dell'Aifa
(rappresentante anche nell'Emea, l'agenzia europea per i farmaci), la sua corsa
in banca per coprire il conto in rosso. Un corto da YouTube agli atti della
richiesta di 20 ordinanze cautelari, su 30 indagati (ma forse saranno di più
dopo gli interrogatori di oggi in carcere a Roma), da parte della procura di
Torino dopo due anni di inchiesta sull'Aifa partita (gennaio 2006) da alcuni
dossier per l'approvazione di alcuni farmaci bioequivalenti o generici. I
provvedimenti, firmati dal gip torinese, riguardano Pasqualino Rossi (carcere)
e Antonella Bove (arresti domiciliari), dirigenti Aifa. Altre ordinanze (tre in
carcere, tre in casa) riguardano procuratori delle aziende: Matteo Mantovani,
Sante Di Renzo, Mario Umbri, Piera Campanella e Francesca Fiorenza. Un sesto
manager è ancora ricercato: sarebbe all'estero.
Tutto registrato, immagini e suoni. Prove contenute nelle 700 pagine
della richiesta di 20 arresti, che poi il Gip ha «sintetizzato » in soli otto
arresti e 400 pagine di ordinanza. Anche Nello Martini, che smentisce di essere
indagato, è protagonista di intercettazioni chiave: le cimici degli
investigatori (i carabinieri dei Nas di Torino, Roma, Padova e Alessandria),
per esempio, ne avrebbero registrato parola per parola un incontro con i
vertici della Glaxo in un albergo di Verona. Che cosa si sono detti è agli
atti. Come agli atti è la storia della figlia di un funzionario Aifa assunta da
una delle aziende di cui il padre doveva essere tra l'altro «controllore». Da
ieri tutto è in mano anche della procura di Roma, che su buona parte
dell'inchiesta è competente. Dei 30 capi d'accusa dell'inchiesta, solo sette
resteranno al vaglio dei magistrati torinesi. Inevitabile il contraccolpo nel
dicastero del Welfare e della Salute. Il ministro Maurizio Sacconi ha deciso
l'avvio di una commissione d'indagine composta da tre «autorevoli esperti»:
dovrà fornire le prime valutazioni tra sette giorni, poi un più completo
rapporto entro il 31 luglio 2008. All'esame un sistema molto raffinatosi dopo
lo scandalo che 15 anni fa ha coinvolto Duilio Poggiolini e
L'ITALIA
DEGLI SCANDALI
Pillole pericolose, si indaga su 12
morti. Il gip sospende il direttore dell'Aifa
Otto
persone già in carcere per un giro di mazzette collegate alle licenze. Il
direttore dell'Agenzia Martini è indagato per disastro colposo: sospeso per due
mesi insieme alla sua vice (di Viviana Ponchia -23 giugno 2008 da
Quotidiano.net). [21]
TORINO, 22 giugno 2008 - "VOGLIO RICREARE
un clima di fiducia con i cittadini e le associazioni degli
ammalati", diceva nell’estate del 2004 il veronese Nello Martini,
prendendo le redini dell’Agenzia italiana del farmaco. L’Aifa era stata appena
istituita ex novo (prima si chiamava Cuf), anche per cancellare l’ombra dello
scandalo Poggiolini.
Cronaca di 15 anni fa. Cronaca di
ieri è la momentanea decapitazione dei vertici dell’Aifa. Martini, finito nell’inchiesta sui
farmaci che a maggio aveva portato il pm torinese Raffaele Guariniello a
chiedere i suoi primi arresti (otto) in 40 anni di carriera, è stato sospeso
per due mesi dalla direzione assieme a Caterina Gualano, dirigente dell’ufficio
che autorizza la messa in commercio delle medicine.
Non lo ha deciso il ministero, anche
se il sottosegretario con delega alla salute, Ferruccio Fazio, assicura che all’inizio della
prossima settimana saranno disponibili le conclusioni dell’indagine predisposta
da una apposita commissione di esperti. L’ha deciso il gip Emanuela Recchione
accogliendo la richiesta della procura di Torino, cui evidentemente i tempi per
una rimozione cautelare dall’alto sembravano ampiamente scaduti.
MARTINI, 61 anni, è indagato per
disastro colposo nell’inchiesta
dai mille risvolti aperta da Guariniello su alcuni farmaci messi in vendita
dopo controlli irregolari. La maggior parte dei 30 capi d’accusa (dalla
corruzione all’ipotesi che è costata a Martini la sospensione), è passata per
competenza ai giudici romani. Guariniello ha tenuto per sé un filone su cui
continua a lavorare in segreto. C’è chi dice abbia a che fare con una dozzina
di decessi sospetti in tutta Italia, quindi sull’eventuale nesso casuale fra
quelle morti e le mazzette pagate, sui danni che corruzione e compiacenze nelle
procedure per autorizzare i medicinali avrebbero potuto causare alla salute
pubblica.
DOPO due anni di indagini e il colpo
di scena di ieri,
ora è plausibile che il ministero, battuto in tempestività dalla magistratura,
sia costretto a commissariare un’agenzia di vitale importanza per il paese.
L’inchiesta era nata nel gennaio del 2006, muovendo i primi passi attorno alla
mancata sperimentazione che poteva garantire guadagni illeciti alle aziende del
settore. Uno studio di bioequivalenza su un farmaco generico era risultato
completamente falso, ma nessuno pensava ci fossero rischi per i consumatori.
Cattivi pensieri vennero collegando le mazzette alla non sospensione di farmaci
(come il nimesulide, principale componente dell’Aulin) ritenuti a rischio da
altri paesi.
GUARINIELLO, partendo dalle bustarelle, è arrivato a imbastire l’ipotesi
di un sistema che potrebbe avere arrecato danno alla salute della gente. Perché
Spagna e Finlandia hanno ritirato l’Aulin nel 2002 e l’Italia no? Le
intercettazioni qualche risposta la forniscono: pagamenti in contanti per
lasciare in pace i «farmaci amici». Lo stesso Nello Martini è vittima delle
cimici degli investigatori, che hanno registrato alla virgola un incontro con i
vertici della Glaxo in un albergo di Verona. Nell’ordinanza, il gip motiva la
sua sospensione con la «gravità indiziaria esposta nell’inchiesta» e scrive che
i due dirigenti dell’Aifa «ciascuno per le proprie competenze, hanno causato
questa situazione e impediscono che siano prese misure adeguate alla
risoluzione delle pendenze, al ritiro delle scorte e all’eliminazione del
pericolo».
L’INDAGINE di Guariniello riguarda in particolare i tempi di
autorizzazioni alle variazioni. La legge prevede una parentesi dai 60 ai 90
giorni, ma in certi casi fra domanda e risposta sarebbero passati anche sette
anni. Ad aspettare che cosa? Forse a far fuori i fondi di magazzino, visto
quello che rileva il giudice: «Anche quando arriva l’autorizzazione alla
variazione, nella massima parte dei casi l’Aifa autorizza lo smaltimento delle
scorte». Nel provvedimento si parla di «disfunzioni organizzative»
dell’agenzia. Per il direttore Martini l’ipotesi è reato colposo, ma gli
inquirenti individuano «una colpa cosciente».
Bibliografia
(1)
Reggio M. “Aulin, Dublino vieta il principio attivo l’Italia:
dobbiamo rivalutare i rischi”.
(2)
Cagliano S., Miselli M. “Il danno da farmaci”. Le Scienze, n. 467 luglio 2007, pp. 64-71.
(3)
Ruesch H., “La
figlia dell’Imperatrice”. Stampa Alternativa, Viterbo 2006.
(4)
Decreto Legislativo 24 aprile 2006 n. 219. Attuazione
della direttiva 2001/83/CE (e
successive
direttive di modifica) relativa ad un codice comunitario concernente i
medicinali per uso umano, nonché della direttiva 2003/94/CE.
(5)
Il punto di
vista. Sperimentazione animale. http://www.airc.it/ricerca-oncologica/il-
punto-di-vista.asp
(6)
Condorelli D. “Cavie!
Nel Sud del mondo si offrono corpi a basso prezzo. Un romanzo
di Le Carré? No, un vero scandalo”. D,
(7)
Pfizer,
multinazionale farmaceutica usa bambini come cavie per un farmaco.
09/05/2006.
(8)
“Ritirato il
nimesulide. che cosa fa l’Italia”.
Salute di repubblica, giovedì 31 maggio 2007 pag. 58, rubrica “Lettere
alla redazione”.
(9)
Reggio M. Farmaci, in Finlandia scatta l'allarme Aulin.
20 marzo 2002.
http://www.repubblica.it/online/cronaca/bayerdue/aulin/aulin.html
(10) Committee for Proprietary Medicinal Products (CPMP) opinion following an
article
31 referral nimesulide containing medicinal products. EMEA, 7 May 2004 CPMP/1724/04 http://www.emea.europa.eu/pdfs/human/referral/nimesulide/172404en.pdf
(11)
Nimesulide:
amica o nemica? venerdì 25 maggio 2007
http://www.paginemediche.it/it/magazine/magazine/farmacologia-clinica/news/detail_60500_nimesulide-amica-o-nemica.aspx?c1=30&c2=399
(12)
Irlanda: divieto di vendita per la nimesulide 18-05-2007
http://www.altroconsumo.it/map/src/164513.htm
(13)
Molti casi di danni al fegato
da nimesulide.
18/05/2007.
http://www.corriere.it/Primo_Piano/Cronache/2007/05_Maggio/17/aulin_vietato.shtml
(14)
Nimesulide ed
epatotossicità. Boll. di informazione sui farmaci, anno XIV n. 3, 2007,
pagg. 112-116.
http://www.agenziafarmaco.it/aifa/servlet/wscs_render_attachment_by_id/111.13656.1184830158893.pdf?id=111.13662.1184830160499
(15)
http://www.agenziafarmaco.it/aifa/servlet/wscs_render_attachment_by_id/111.114567.11
88572359215.pdf?id=111.113589.1188570384846
(16)
Saha
K. 2003: “Use of Nimesulide in Indian children must be stopped”
http://bmj.bmjjournals.com/cgi/content/full/326/7391/713
(17)
EMEA “European Medicines Agency recommends restricted use of
nimesulide-containing medicinal products” 21 settembre
(18)
AIFA. Domande e
risposte su Nimesulide. http://www.agenziafarmaco.it/wscs_render_attachment_by_id/111.164127.1190376446839c9f2.pdf?id=111.164133.1190376447125
(19)
http://www.rtgpuglia.it/leggi_news.asp?ID=5869
(20)
“Mazzette per evitare i controlli sull'Aulin” Farmaci e
tangenti, filmata la consegna di soldi al vice capo dell'Aifa. Mario
Pappagallo, Corriere della Sera, 23
maggio 2008
(21)
“Pillole pericolose, si indaga su 12 morti. Il gip
sospende il direttore dell'Aifa” (di Viviana Ponchia, 23 giugno 2008,
Quotidiano.net)
http://qn.quotidiano.net/cronaca/2008/06/22/98875-pillole_pericolose_indaga_morti.shtml)
Inserito: 6 luglio 2008
Scienza e Democrazia/Science and Democracy